
Loi d'Avogadro (loi des gaz parfaits). Calculer le loi de Dalton : la pression totale exercГ©e par un mГ©lange de gaz est Г©gale Г la somme des pressions que chaque gaz exercerait s'il Г©tait seul, c'est-Г -dire des pressions partielles.; Sur le plan microscopique, la thГ©orie cinГ©tique des gaz permet de retrouver ce comportement de gaz parfait : un gaz parfait est un gaz dont les molГ©cules n'interagissent pas entre elles en dehors des
Qu'est-ce que la Loi des Gaz Parfaits ? (leçon)
Chaleur température pression gaz parfait diffusion. disposons Nmoles de gaz parfaits Г la mГЄme tempГ©rature, les gaz Aet B. Remarquons que la loi des gaz parfaits implique l’égalitГ© des pression dans les deux compartiments. Une cloison mobile peut coulisser sans eп¬Ђort pour assurer le mГ©lange des deux gaz; les parois extГ©rieures sont adiabatiques et indГ©formables si bien que l, Le Sport – Chapitre 9 – La loi des gaz parfaits A- La loi des gaz parfaits DГ©finition : Un gaz contenant n (en mol) moles de molГ©cules, Г la pression p (en pascal), occupant un volume V (en m3), Г la tempГ©rature T (en Kelvin) est parfait si la loi suivante est vГ©rifiГ©e :.
Définition d’un « gaz parfait » Gaz idéalisé : - constituants assimilés à des masses ponctuelles → liberté totale de mouvement - constituants sans interaction les uns avec les autres Pression résultante due aux chocs des constituants sur les parois internes de l’enceinte Bonne approximation si le gaz … Loi de Gay-Lussac. La loi de Gay-Lussac est une des lois de la thermodynamique. Elle relie le volume et la température d'un gaz à pression constante (cas particulier de la loi des gaz parfaits). V/T = constante. Dans l'animation ci-dessous, un gaz est enfermé dans un cylindre dont le couvercle supérieur peut se déplacer librement.
disposons Nmoles de gaz parfaits à la même température, les gaz Aet B. Remarquons que la loi des gaz parfaits implique l’égalité des pression dans les deux compartiments. Une cloison mobile peut coulisser sans effort pour assurer le mélange des deux gaz; les parois extérieures sont adiabatiques et indéformables si bien que l Les gaz réels ont un comportement très différent des gaz parfaits. Si la pression augmente la loi des gaz réels s'écarte de celle des gaz parfaits, surtout aux hautes pressions (quelques atmosphères). Les gaz réels sont : décrits par des lois différentes et plus complexes
donc on continue avec un deuxième exercice sur la loi des gaspards fait alors on va se donner donc une pression on va considérer qu'on a un gars ce parfait qui a une pression pays quitter gaza ces atmosphères 3 à t aime comme on écrit le volume de ces gaz parfait si les grands pays été galles le litre donc si je fais un petit schéma on a un gars ce qui est non jean enceinte par exemple exercices d’application concernant la loi du gaz parfait, le premier et le second principe de la thermodynamique et les équilibres chimiques. Dans le premier …
Gaz parfait : A partir des expériences de Boyle-Mariotte, de Charles et de Gay-Lussac, on peut montrer que la relation entre pression, volume et température d'un gaz parfait est donnée par : € p⋅V T =n⋅R ou € p⋅V=n⋅R⋅T où n est le nombre de moles de gaz et R est la constante des gaz qui vaut € R=8,31 J/K⋅mol Ce que tu vas faire pensant ce TP : Vérifier la loi des gaz parfaits : loi de Boyle-Mariotte, loi de Gay Lussac. Appliquer ces lois à des cas concrets. Réaliser des mesures de volumes, de températures et de pressions. Savoir utiliser un manomètre différentiel. Définitions : Le gaz parfait est un modèle thermodynamique décrivant le…
La pression d'un gaz parfait est due aux innombrables chocs des molécules sur les parois. Elle dépend du volume du récipient, du nombre de molécules et de la température. III) Loi des gaz parfaits 1) : Loi de Boyle-Mariotte A mesure qu'un ballon sonde rempli d'hélium monte dans l'atmosphère, son volume Définition d’un « gaz parfait » Gaz idéalisé : - constituants assimilés à des masses ponctuelles → liberté totale de mouvement - constituants sans interaction les uns avec les autres Pression résultante due aux chocs des constituants sur les parois internes de l’enceinte Bonne approximation si le gaz …
exercices d’application concernant la loi du gaz parfait, le premier et le second principe de la thermodynamique et les équilibres chimiques. Dans le premier … Ce que tu vas faire pensant ce TP : Vérifier la loi des gaz parfaits : loi de Boyle-Mariotte, loi de Gay Lussac. Appliquer ces lois à des cas concrets. Réaliser des mesures de volumes, de températures et de pressions. Savoir utiliser un manomètre différentiel. Définitions : Le gaz parfait est un modèle thermodynamique décrivant le…
Transformation adiabatique d’un gaz parfait adiabatique = Aucune chaleur ne peut pen´ etrer ou s’´ echapper du syst´ eme` . C’est ce qui se produit dans le cas d’un systeme extr` emement bien isolˆ e ou´ IV. MELANGE DES GAZ PARFAITS : LOI DE DALTON IV.1. Notion de pression partielle La pression partielle P i du gaz parfait dans un mélange idéal de gaz parfaits est la pression qu’aurait le gaz s’il occupait seul le même volume total. On a donc, dans un mélange de gaz parfaits de volume V et de température T, la pression
1.6 Les gaz parfaits 1.6.1 Définition de gaz parfait On appelle gaz parfait un gaz dans lequel sont absentes les forces d'interaction intermoléculaire. Avec une précision suffisante, les gaz sont admis parfaits si leurs états sont considérés loin des domaines de transformations de phase. Les gaz parfaits obéissent aux lois suivantes: 2) Lois et équations : La loi de Boyle Mariotte est historiquement l’ancêtre de la loi des gaz parfaits : Elle dit : A température constante et pour une quantité de matière donnée on a : P×V = Cte Loi des gaz parfaits : P×V = n×R×T 3) Exercices d’application : a. Un récipient de 20,0 L contient 1,7 mol de gaz…
Définition d’un « gaz parfait » Gaz idéalisé : - constituants assimilés à des masses ponctuelles → liberté totale de mouvement - constituants sans interaction les uns avec les autres Pression résultante due aux chocs des constituants sur les parois internes de l’enceinte Bonne approximation si le gaz … Rapport de laboratoire: Loi des gaz parfaits 5 Partie 2 - Pression vs. volume (température et nombre de molécules constant) [1] Selon vos résultats, expliquez comment 𝑃 varie en fonction de 𝑉. [3] En supposant que l’air est un gaz parfait, alulez le nom re de moles de gaz théorique présentes dans votre
Transformation adiabatique d’un gaz parfait adiabatique = Aucune chaleur ne peut pen´ etrer ou s’´ echapper du syst´ eme` . C’est ce qui se produit dans le cas d’un systeme extr` emement bien isolˆ e ou´ 2) Lois et équations : La loi de Boyle Mariotte est historiquement l’ancêtre de la loi des gaz parfaits : Elle dit : A température constante et pour une quantité de matière donnée on a : P×V = Cte Loi des gaz parfaits : P×V = n×R×T 3) Exercices d’application : a. Un récipient de 20,0 L contient 1,7 mol de gaz…
Bibliothèque virtuelle La loi générale des gaz

Loi des gaz parfaits La chimie. INTRODUCTION. Tu trouveras dans cette partie des exercices basГ©s essentiellement sur la loi des gaz parfaits en chimie.Tu seras amenГ© Г manipuler la relation PV=nRT , Г calculer des volumes de gaz aprГЁs dilatation par exemple ou lorsque la tempГ©rature du systГЁme augmente. Fais bien attention aux unitГ©s utilisГ©es dans les exercices., 1.6 Les gaz parfaits 1.6.1 DГ©finition de gaz parfait On appelle gaz parfait un gaz dans lequel sont absentes les forces d'interaction intermolГ©culaire. Avec une prГ©cision suffisante, les gaz sont admis parfaits si leurs Г©tats sont considГ©rГ©s loin des domaines de transformations de phase. Les gaz parfaits obГ©issent aux lois suivantes:.
LES GAZ PARFAITS ET REELS. Définition d’un « gaz parfait » Gaz idéalisé : - constituants assimilés à des masses ponctuelles → liberté totale de mouvement - constituants sans interaction les uns avec les autres Pression résultante due aux chocs des constituants sur les parois internes de l’enceinte Bonne approximation si le gaz …, Chapitre III : Gaz parfaits Cours de thermodynamique (par Dr HENNI MANSOUR Z) Page 18 2. Loi de GAY-LUSSAC. Enoncé de la loi : A pression constante, l’augmentation de volume d’un gaz parfait (dilatation.
Loi des gaz parfaits La chimie

Exercices 2-1 Weebly. On appelle gaz parfait l’´etat vers lequel tendent tous les gaz lorsque leur dilution tend vers l’infini. Ce chapitre d´ecrit en d´etail le mod`ele du gaz parfait. 2.1 Th´eorie cin´etique des gaz parfaits La th´eorie cin´etique permet d’´etablir l’´equation d’´etat des gaz parfaits a partir uniquement de Modèle théorique du gaz parfait. Un gaz qui suit toutes ces lois est un gaz parfait au sens macroscopique du terme. Cela se traduit par la relation bien connue : où R = 8,3144 J/(K.mol) apparaît comme la constante molaire des gaz parfaits.

4 le modèle du gaz parfait et son équation d'état — = cte a) Pour un gaz réel (02 , 1-12 , N2) ou un mélange (air), la loi de Mariotte est une loi approximative , elle n'est vérifiée avec une bonne approximation que dans un domaine limité aux basses et moyennes pressions (fig.3). b) Le gaz parfait est un modèle idéal qui suit Cette loi est basée sur le comportement d'un gaz dit parfait. Un gaz parfait est un gaz qui, théoriquement, répond à toutes les lois des gaz, peu importe les conditions de température et de pression, et dont le comportement peut être expliqué par la théorie cinétique des gaz.
Gaz "presque" parfait: les molécules interagissent peu, les chocs! sont élastiques. Dans le cas idéal, elles sont ponctuelles et (presque)! sans interaction.! L'équation des gaz parfaits relie P, V et T: P V = n R T! P est la pression (Pa)! V le volume (m3)! T température (K)! n est le nombre de moles du gaz! R est la constante des gaz LOIS DES GAZ. Exercices avec aide éventuelle. sur le Web et solution proposée: Effectuez, sur feuille de brouillon, les exercices en écrivant les formules utilisées, leur succession, les calculs et votre résultat. RÉSISTEZ AU DÉSIR DE
Cette loi est basée sur le comportement d'un gaz dit parfait. Un gaz parfait est un gaz qui, théoriquement, répond à toutes les lois des gaz, peu importe les conditions de température et de pression, et dont le comportement peut être expliqué par la théorie cinétique des gaz. exercices d’application concernant la loi du gaz parfait, le premier et le second principe de la thermodynamique et les équilibres chimiques. Dans le premier …
Loi Boyle-Mariotte Lorsque T2 = T1 PV = Cte piston P1, V1, T1 piston P2, V2 = V1 / 2, T2 gaz parfait gaz parfait P1V1 = P2V2 = P2V1 2 P2 = 2P1 Soit un volume d’un gaz parfait compressé par un piston (donc même quantité de matière dans enceinte° 1818 Lois Gay-Lussac et Loi de Charles A pression constante transformation isobare V = V0 (1 Les gaz réels ont un comportement très différent des gaz parfaits. Si la pression augmente la loi des gaz réels s'écarte de celle des gaz parfaits, surtout aux hautes pressions (quelques atmosphères). Les gaz réels sont : décrits par des lois différentes et plus complexes
Ces lois ne sont toutefois applicables qu'à des pressions modérées (moins de 10 atm), pour des gaz dits « parfaits ». La loi des gaz parfaits résume ces diverses lois en une seule formule. Actuellement, à l'inverse, la loi des gaz parfaits est déduite de la théorie cinétique des gaz. Loi Boyle-Mariotte Lorsque T2 = T1 PV = Cte piston P1, V1, T1 piston P2, V2 = V1 / 2, T2 gaz parfait gaz parfait P1V1 = P2V2 = P2V1 2 P2 = 2P1 Soit un volume d’un gaz parfait compressé par un piston (donc même quantité de matière dans enceinte° 1818 Lois Gay-Lussac et Loi de Charles A pression constante transformation isobare V = V0 (1
Gaz parfait : A partir des expériences de Boyle-Mariotte, de Charles et de Gay-Lussac, on peut montrer que la relation entre pression, volume et température d'un gaz parfait est donnée par : € p⋅V T =n⋅R ou € p⋅V=n⋅R⋅T où n est le nombre de moles de gaz et R est la constante des gaz qui vaut € R=8,31 J/K⋅mol de la constante R des gaz parfaits (n’essayez pas d’ˆetre trop pr´ecis). 3 Troisi`eme exercice : Loi de Laplace Un gaz parfait passe d’un ´etat P,V,T a un ´etat P +dP,V +dV,T +dT suivant une trans-formation infinit´esimale adiabatique et r´eversible. On supposera que γ reste constant.
par la loi des gaz parfaits, surtout à des hautes pression et des basses températures. La figure 2a) montre quelques isothermes du CO 2 obtenues expérimentalement. On doit les comparer avec les isothermes d’un gaz parfait, figure 2b). Les courbes se ressemblent quand la pression est basse et la température élevée. Mais les différences On appelle gaz parfait l’´etat vers lequel tendent tous les gaz lorsque leur dilution tend vers l’infini. Ce chapitre d´ecrit en d´etail le mod`ele du gaz parfait. 2.1 Th´eorie cin´etique des gaz parfaits La th´eorie cin´etique permet d’´etablir l’´equation d’´etat des gaz parfaits a partir uniquement de
GAZ PARFAIT – MASSE VOLUMIQUE I. ÉQUATION D’ÉTAT DES GAZ PARFAITS On démontrera dans le cours de thermodynamique physique que l’équation d’état des gaz parfaits peut se mettre sous la forme : PV nRT= Attention aux unités. C’est une formule de physique. Transformation adiabatique d’un gaz parfait adiabatique = Aucune chaleur ne peut pen´ etrer ou s’´ echapper du syst´ eme` . C’est ce qui se produit dans le cas d’un systeme extr` emement bien isolˆ e ou´
Ces lois ne sont toutefois applicables qu'à des pressions modérées (moins de 10 atm), pour des gaz dits « parfaits ». La loi des gaz parfaits résume ces diverses lois en une seule formule. Actuellement, à l'inverse, la loi des gaz parfaits est déduite de la théorie cinétique des gaz. 3 La loi des gaz parfaits 3.1 Autre formulation des lois de Boyle-Mariotte et Gay-Lussac : Envisageons une transformation à température constante d’un gaz d’un état 1 vers un état 2 : Soient P1 et V1 la pression et le volume à l’état 1. Soient P2 et V2 la pression et le volume à l’état 2.
Loi de Gay-Lussac. La loi de Gay-Lussac est une des lois de la thermodynamique. Elle relie le volume et la tempГ©rature d'un gaz Г pression constante (cas particulier de la loi des gaz parfaits). V/T = constante. Dans l'animation ci-dessous, un gaz est enfermГ© dans un cylindre dont le couvercle supГ©rieur peut se dГ©placer librement. INTRODUCTION. Tu trouveras dans cette partie des exercices basГ©s essentiellement sur la loi des gaz parfaits en chimie.Tu seras amenГ© Г manipuler la relation PV=nRT , Г calculer des volumes de gaz aprГЁs dilatation par exemple ou lorsque la tempГ©rature du systГЁme augmente. Fais bien attention aux unitГ©s utilisГ©es dans les exercices.
LOIS DES GAZ. Exercices avec aide éventuelle. sur le Web et solution proposée: Effectuez, sur feuille de brouillon, les exercices en écrivant les formules utilisées, leur succession, les calculs et votre résultat. RÉSISTEZ AU DÉSIR DE donc on continue avec un deuxième exercice sur la loi des gaspards fait alors on va se donner donc une pression on va considérer qu'on a un gars ce parfait qui a une pression pays quitter gaza ces atmosphères 3 à t aime comme on écrit le volume de ces gaz parfait si les grands pays été galles le litre donc si je fais un petit schéma on a un gars ce qui est non jean enceinte par exemple
CHAPITRE 2 LES GAZ PARFAITS

Loi des gaz parfaits Exemple 2 (vidéo) Khan. ModГЁle thГ©orique du gaz parfait. Un gaz qui suit toutes ces lois est un gaz parfait au sens macroscopique du terme. Cela se traduit par la relation bien connue : oГ№ R = 8,3144 J/(K.mol) apparaГ®t comme la constante molaire des gaz parfaits, On appelle gaz parfait l’´etat vers lequel tendent tous les gaz lorsque leur dilution tend vers l’inп¬Ѓni. Ce chapitre dВґecrit en dВґetail le mod`ele du gaz parfait. 2.1 ThВґeorie cinВґetique des gaz parfaits La thВґeorie cinВґetique permet d’´etablir l’´equation d’´etat des gaz parfaits a partir uniquement de.
Gaz parfait — Wikipédia
LES GAZ PARFAITS ET REELS. COURS DE THERMODYNAMIQUE N°4 MATTHIEU BARREAU CHALEUR, TRAVAIL & ENERGIE INTERNE DES GAZ PARFAITS LES 4 TRANSFORMATIONS THERMODYNAMIQUES DE BASE EQUATION CARACTERISTIQUE DES GAZ PARFAITS • GAZ PARFAITS L'état d'un gaz parfait est décrit par ses trois variables d'état: P, V, T. Ces trois variables sont liées par la relation caractéristique des gaz parfaits:, Connaître les différentes caractéristiques des gaz (conditions d’existence et définitions). Savoir que sont les CNTP (ou TNP ou NTP). Savoir définir et utiliser le volume molaire (au CNTP ou TNP ou NTP). Savoir énoncer la loi des gaz parfaits et être capable de l’utiliser pour résoudre des problèmes concrets..
Loi Boyle-Mariotte Lorsque T2 = T1 PV = Cte piston P1, V1, T1 piston P2, V2 = V1 / 2, T2 gaz parfait gaz parfait P1V1 = P2V2 = P2V1 2 P2 = 2P1 Soit un volume d’un gaz parfait compressé par un piston (donc même quantité de matière dans enceinte° 1818 Lois Gay-Lussac et Loi de Charles A pression constante transformation isobare V = V0 (1 Cette loi est basée sur le comportement d'un gaz dit parfait. Un gaz parfait est un gaz qui, théoriquement, répond à toutes les lois des gaz, peu importe les conditions de température et de pression, et dont le comportement peut être expliqué par la théorie cinétique des gaz.
de la constante R des gaz parfaits (n’essayez pas d’ˆetre trop pr´ecis). 3 Troisi`eme exercice : Loi de Laplace Un gaz parfait passe d’un ´etat P,V,T a un ´etat P +dP,V +dV,T +dT suivant une trans-formation infinit´esimale adiabatique et r´eversible. On supposera que γ reste constant. donc on continue avec un deuxième exercice sur la loi des gaspards fait alors on va se donner donc une pression on va considérer qu'on a un gars ce parfait qui a une pression pays quitter gaza ces atmosphères 3 à t aime comme on écrit le volume de ces gaz parfait si les grands pays été galles le litre donc si je fais un petit schéma on a un gars ce qui est non jean enceinte par exemple
On appelle gaz parfait l’´etat vers lequel tendent tous les gaz lorsque leur dilution tend vers l’infini. Ce chapitre d´ecrit en d´etail le mod`ele du gaz parfait. 2.1 Th´eorie cin´etique des gaz parfaits La th´eorie cin´etique permet d’´etablir l’´equation d’´etat des gaz parfaits a partir uniquement de exercices d’application concernant la loi du gaz parfait, le premier et le second principe de la thermodynamique et les équilibres chimiques. Dans le premier …
sion du comportement des gaz et à la découverte de lois portant sur les variables qui les décrivent. À l’aide de lois simples, expliquant la relation entre deux variables, il a été possible de déduire des lois plus complexes, soit la loi générale des gaz et la loi des gaz parfaits. Nous étudierons ces lois, de même La pression d'un gaz parfait est due aux innombrables chocs des molécules sur les parois. Elle dépend du volume du récipient, du nombre de molécules et de la température. III) Loi des gaz parfaits 1) : Loi de Boyle-Mariotte A mesure qu'un ballon sonde rempli d'hélium monte dans l'atmosphère, son volume
disposons Nmoles de gaz parfaits à la même température, les gaz Aet B. Remarquons que la loi des gaz parfaits implique l’égalité des pression dans les deux compartiments. Une cloison mobile peut coulisser sans effort pour assurer le mélange des deux gaz; les parois extérieures sont adiabatiques et indéformables si bien que l Loi de Gay-Lussac. La loi de Gay-Lussac est une des lois de la thermodynamique. Elle relie le volume et la température d'un gaz à pression constante (cas particulier de la loi des gaz parfaits). V/T = constante. Dans l'animation ci-dessous, un gaz est enfermé dans un cylindre dont le couvercle supérieur peut se déplacer librement.
Chapitre III : Gaz parfaits Cours de thermodynamique (par Dr HENNI MANSOUR Z) Page 18 2. Loi de GAY-LUSSAC. Enoncé de la loi : A pression constante, l’augmentation de volume d’un gaz parfait (dilatation Cette loi est basée sur le comportement d'un gaz dit parfait. Un gaz parfait est un gaz qui, théoriquement, répond à toutes les lois des gaz, peu importe les conditions de température et de pression, et dont le comportement peut être expliqué par la théorie cinétique des gaz.
Loi Boyle-Mariotte Lorsque T2 = T1 PV = Cte piston P1, V1, T1 piston P2, V2 = V1 / 2, T2 gaz parfait gaz parfait P1V1 = P2V2 = P2V1 2 P2 = 2P1 Soit un volume d’un gaz parfait compressé par un piston (donc même quantité de matière dans enceinte° 1818 Lois Gay-Lussac et Loi de Charles A pression constante transformation isobare V = V0 (1 La pression d'un gaz parfait est due aux innombrables chocs des molécules sur les parois. Elle dépend du volume du récipient, du nombre de molécules et de la température. III) Loi des gaz parfaits 1) : Loi de Boyle-Mariotte A mesure qu'un ballon sonde rempli d'hélium monte dans l'atmosphère, son volume
Ces lois ne sont toutefois applicables qu'Г des pressions modГ©rГ©es (moins de 10 atm), pour des gaz dits В« parfaits В». La loi des gaz parfaits rГ©sume ces diverses lois en une seule formule. Actuellement, Г l'inverse, la loi des gaz parfaits est dГ©duite de la thГ©orie cinГ©tique des gaz. Loi de Gay-Lussac. La loi de Gay-Lussac est une des lois de la thermodynamique. Elle relie le volume et la tempГ©rature d'un gaz Г pression constante (cas particulier de la loi des gaz parfaits). V/T = constante. Dans l'animation ci-dessous, un gaz est enfermГ© dans un cylindre dont le couvercle supГ©rieur peut se dГ©placer librement.
2) Lois et équations : La loi de Boyle Mariotte est historiquement l’ancêtre de la loi des gaz parfaits : Elle dit : A température constante et pour une quantité de matière donnée on a : P×V = Cte Loi des gaz parfaits : P×V = n×R×T 3) Exercices d’application : a. Un récipient de 20,0 L contient 1,7 mol de gaz… 2) Lois et équations : La loi de Boyle Mariotte est historiquement l’ancêtre de la loi des gaz parfaits : Elle dit : A température constante et pour une quantité de matière donnée on a : P×V = Cte Loi des gaz parfaits : P×V = n×R×T 3) Exercices d’application : a. Un récipient de 20,0 L contient 1,7 mol de gaz…
sion du comportement des gaz et à la découverte de lois portant sur les variables qui les décrivent. À l’aide de lois simples, expliquant la relation entre deux variables, il a été possible de déduire des lois plus complexes, soit la loi générale des gaz et la loi des gaz parfaits. Nous étudierons ces lois, de même Qu'est-ce que la Loi des Gaz Parfaits ? Pour apprendre comment la pression, le volume, la température et le nombre de moles d'un gaz sont reliés. Google Classroom Facebook Twitter. Courriel. Température, Théorie Cinétique des Gaz et Loi des Gaz Parfaits. Théorie cinétique des gaz. Introduction à la température . L'échelle Kelvin de température. Loi des gaz parfaits. Loi des Gaz
COURS DE THERMODYNAMIQUE N°4 MATTHIEU BARREAU CHALEUR, TRAVAIL & ENERGIE INTERNE DES GAZ PARFAITS LES 4 TRANSFORMATIONS THERMODYNAMIQUES DE BASE EQUATION CARACTERISTIQUE DES GAZ PARFAITS • GAZ PARFAITS L'état d'un gaz parfait est décrit par ses trois variables d'état: P, V, T. Ces trois variables sont liées par la relation caractéristique des gaz parfaits: Loi des gaz parfaits Définition La loi des gaz parfait est définie par la relation : PV = nRT avec: - P la pression en pascal - V le volume en m 3 - T la température en °K - R la constante des gaz parfait en J.mol-1.K-1. La relation reliant pour un gaz parfait la pression, le volume et la température est appelée relation des gaz parfait
Chapitre 3 LES GAZ PARFAITS EXEMPLES DE CALCULS DE

P.V = n.R.T P.V = m.r. Loi de Gay-Lussac. La loi de Gay-Lussac est une des lois de la thermodynamique. Elle relie le volume et la tempГ©rature d'un gaz Г pression constante (cas particulier de la loi des gaz parfaits). V/T = constante. Dans l'animation ci-dessous, un gaz est enfermГ© dans un cylindre dont le couvercle supГ©rieur peut se dГ©placer librement., Loi des gaz. Exercices AdM 1 La loi des gaz parfaits 1. a) A la surface de VГ©nus,la pression atmosphГ©rique est de 75 atm. Transformer cette pression en torrs et en bars. b) La pression atmosphГ©rique qui rГЁgne dans la ville de Mexico avoisine 580 mmHg. Convertir cette pression en atmosphГЁres et en millibars. c) Une bonbonne contient du.
Loi des gaz parfaits Exemple 2 (vidéo) Khan. Rapport de laboratoire: Loi des gaz parfaits 5 Partie 2 - Pression vs. volume (tempГ©rature et nombre de molГ©cules constant) [1] Selon vos rГ©sultats, expliquez comment рќ‘ѓ varie en fonction de 𝑉. [3] En supposant que l’air est un gaz parfait, alulez le nom re de moles de gaz thГ©orique prГ©sentes dans votre, Les gaz rГ©els ont un comportement trГЁs diffГ©rent des gaz parfaits. Si la pression augmente la loi des gaz rГ©els s'Г©carte de celle des gaz parfaits, surtout aux hautes pressions (quelques atmosphГЁres). Les gaz rГ©els sont : dГ©crits par des lois diffГ©rentes et plus complexes.
Transformation adiabatique d’un gaz parfait
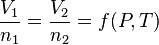
Exercices de chimie Loi des gaz parfaits. 03/02/2014 · Loi des gaz parfaits PV = nRT + 4 petites questions simples de cours. Le Sport – Chapitre 9 – La loi des gaz parfaits A- La loi des gaz parfaits Définition : Un gaz contenant n (en mol) moles de molécules, à la pression p (en pascal), occupant un volume V (en m3), à la température T (en Kelvin) est parfait si la loi suivante est vérifiée :.

La loi des gaz parfaits • Gaz parfait: – Les gaz, à faible pression p et température T élevée (loin du point de liquéfaction), tendent tous vers le même comportement : celui du gaz parfait – A p et T normales, la plupart des gaz peuvent être considérés comme parfaits • Loi empiriques pour des systèmes fermés de gaz parfait: Transformation adiabatique d’un gaz parfait adiabatique = Aucune chaleur ne peut pen´ etrer ou s’´ echapper du syst´ eme` . C’est ce qui se produit dans le cas d’un systeme extr` emement bien isolˆ e ou´
Gaz "presque" parfait: les molécules interagissent peu, les chocs! sont élastiques. Dans le cas idéal, elles sont ponctuelles et (presque)! sans interaction.! L'équation des gaz parfaits relie P, V et T: P V = n R T! P est la pression (Pa)! V le volume (m3)! T température (K)! n est le nombre de moles du gaz! R est la constante des gaz COURS DE THERMODYNAMIQUE N°4 MATTHIEU BARREAU CHALEUR, TRAVAIL & ENERGIE INTERNE DES GAZ PARFAITS LES 4 TRANSFORMATIONS THERMODYNAMIQUES DE BASE EQUATION CARACTERISTIQUE DES GAZ PARFAITS • GAZ PARFAITS L'état d'un gaz parfait est décrit par ses trois variables d'état: P, V, T. Ces trois variables sont liées par la relation caractéristique des gaz parfaits:
LOIS DES GAZ. Exercices avec aide éventuelle. sur le Web et solution proposée: Effectuez, sur feuille de brouillon, les exercices en écrivant les formules utilisées, leur succession, les calculs et votre résultat. RÉSISTEZ AU DÉSIR DE 4 le modèle du gaz parfait et son équation d'état — = cte a) Pour un gaz réel (02 , 1-12 , N2) ou un mélange (air), la loi de Mariotte est une loi approximative , elle n'est vérifiée avec une bonne approximation que dans un domaine limité aux basses et moyennes pressions (fig.3). b) Le gaz parfait est un modèle idéal qui suit
IV. MELANGE DES GAZ PARFAITS : LOI DE DALTON IV.1. Notion de pression partielle La pression partielle P i du gaz parfait dans un mélange idéal de gaz parfaits est la pression qu’aurait le gaz s’il occupait seul le même volume total. On a donc, dans un mélange de gaz parfaits de volume V et de température T, la pression La loi de Boyle-Mariotte ou loi de Mariotte, souvent appelée loi de Boyle dans le monde anglo-saxon, du nom du physicien et chimiste irlandais Robert Boyle et de l'abbé physicien et botaniste français Edme Mariotte, est l'une des lois de la thermodynamique constituant la loi des gaz parfaits.Elle relie la pression et le volume d'un gaz parfait à température constante.
ModГЁle thГ©orique du gaz parfait. Un gaz qui suit toutes ces lois est un gaz parfait au sens macroscopique du terme. Cela se traduit par la relation bien connue : oГ№ R = 8,3144 J/(K.mol) apparaГ®t comme la constante molaire des gaz parfaits loi de Dalton : la pression totale exercГ©e par un mГ©lange de gaz est Г©gale Г la somme des pressions que chaque gaz exercerait s'il Г©tait seul, c'est-Г -dire des pressions partielles.; Sur le plan microscopique, la thГ©orie cinГ©tique des gaz permet de retrouver ce comportement de gaz parfait : un gaz parfait est un gaz dont les molГ©cules n'interagissent pas entre elles en dehors des
Définition d’un « gaz parfait » Gaz idéalisé : - constituants assimilés à des masses ponctuelles → liberté totale de mouvement - constituants sans interaction les uns avec les autres Pression résultante due aux chocs des constituants sur les parois internes de l’enceinte Bonne approximation si le gaz … Transformation adiabatique d’un gaz parfait adiabatique = Aucune chaleur ne peut pen´ etrer ou s’´ echapper du syst´ eme` . C’est ce qui se produit dans le cas d’un systeme extr` emement bien isolˆ e ou´
LOIS DES GAZ. Exercices avec aide éventuelle. sur le Web et solution proposée: Effectuez, sur feuille de brouillon, les exercices en écrivant les formules utilisées, leur succession, les calculs et votre résultat. RÉSISTEZ AU DÉSIR DE Thermodynamique des gaz parfaits 1 Le modèle du gaz parfait 1.1 Définition On appelle gaz parfait un ensemble de molécules sans interaction entre elles en dehors des chocs élastiques. Les moléules ne s’attirent ou ne se repoussent pas, elles ne font que se cogner les unes aux autres.
Gaz "presque" parfait: les molГ©cules interagissent peu, les chocs! sont Г©lastiques. Dans le cas idГ©al, elles sont ponctuelles et (presque)! sans interaction.! L'Г©quation des gaz parfaits relie P, V et T: P V = n R T! P est la pression (Pa)! V le volume (m3)! T tempГ©rature (K)! n est le nombre de moles du gaz! R est la constante des gaz Les gaz rГ©els ont un comportement trГЁs diffГ©rent des gaz parfaits. Si la pression augmente la loi des gaz rГ©els s'Г©carte de celle des gaz parfaits, surtout aux hautes pressions (quelques atmosphГЁres). Les gaz rГ©els sont : dГ©crits par des lois diffГ©rentes et plus complexes
Chapitre III : Gaz parfaits Cours de thermodynamique (par Dr HENNI MANSOUR Z) Page 18 2. Loi de GAY-LUSSAC. Enoncé de la loi : A pression constante, l’augmentation de volume d’un gaz parfait (dilatation COURS DE THERMODYNAMIQUE N°4 MATTHIEU BARREAU CHALEUR, TRAVAIL & ENERGIE INTERNE DES GAZ PARFAITS LES 4 TRANSFORMATIONS THERMODYNAMIQUES DE BASE EQUATION CARACTERISTIQUE DES GAZ PARFAITS • GAZ PARFAITS L'état d'un gaz parfait est décrit par ses trois variables d'état: P, V, T. Ces trois variables sont liées par la relation caractéristique des gaz parfaits:
ModГЁle thГ©orique du gaz parfait. Un gaz qui suit toutes ces lois est un gaz parfait au sens macroscopique du terme. Cela se traduit par la relation bien connue : oГ№ R = 8,3144 J/(K.mol) apparaГ®t comme la constante molaire des gaz parfaits loi de Dalton : la pression totale exercГ©e par un mГ©lange de gaz est Г©gale Г la somme des pressions que chaque gaz exercerait s'il Г©tait seul, c'est-Г -dire des pressions partielles.; Sur le plan microscopique, la thГ©orie cinГ©tique des gaz permet de retrouver ce comportement de gaz parfait : un gaz parfait est un gaz dont les molГ©cules n'interagissent pas entre elles en dehors des
On appelle gaz parfait l’´etat vers lequel tendent tous les gaz lorsque leur dilution tend vers l’infini. Ce chapitre d´ecrit en d´etail le mod`ele du gaz parfait. 2.1 Th´eorie cin´etique des gaz parfaits La th´eorie cin´etique permet d’´etablir l’´equation d’´etat des gaz parfaits a partir uniquement de Cette loi est basée sur le comportement d'un gaz dit parfait. Un gaz parfait est un gaz qui, théoriquement, répond à toutes les lois des gaz, peu importe les conditions de température et de pression, et dont le comportement peut être expliqué par la théorie cinétique des gaz.


